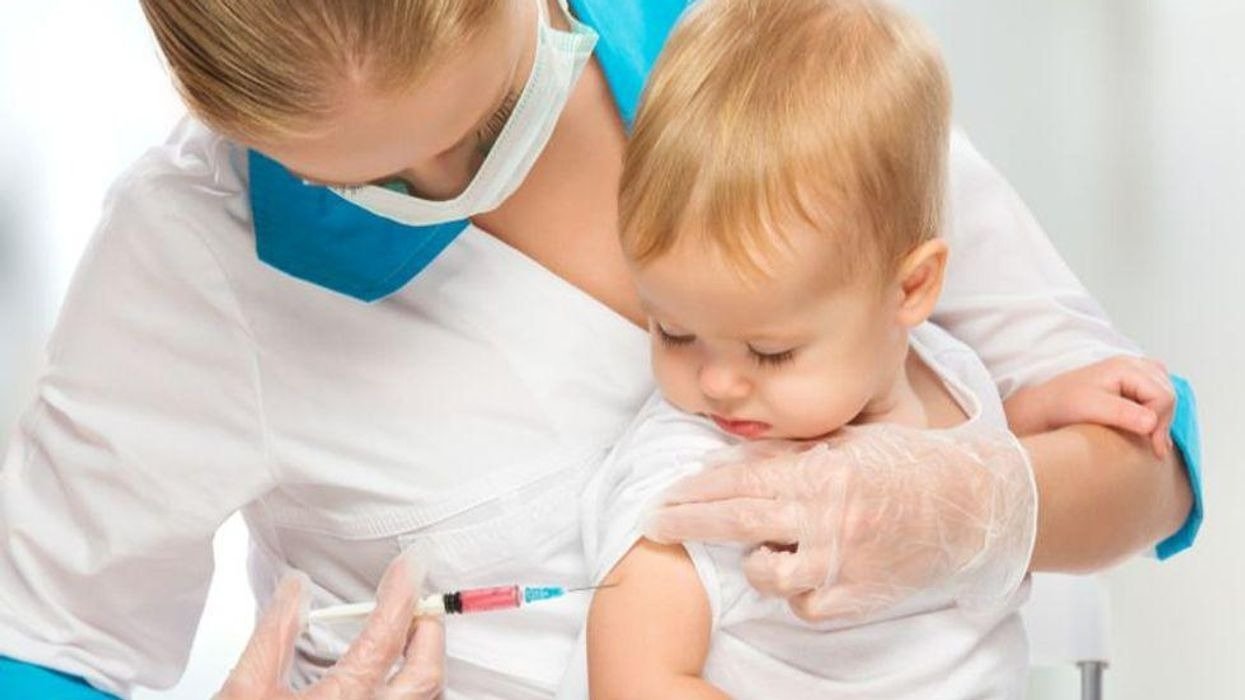
据路透社报道,FDA周五表示,将推迟关于辉瑞6个月至4岁儿童新冠疫苗申请授权的讨论会议。
辉瑞和BioNTech 的一份声明中表示,他们计划延长向美国监管机构提交5岁以下儿童注射疫苗数据的流程。
美国监管机构一直在考虑为尚未有资格接种疫苗的唯一年龄组提供新冠疫苗,尽管这些公司表示,初步结果2至4岁儿童的免疫效果没有达到预期。
去年12月,辉瑞公司表示,它正在修改其临床试验,以测试三剂量版本的疫苗,因为低剂量使用在2至4岁的儿童中产生的免疫效果低于16至25岁人群的免疫效果。
该公司表示,他们应美国食品和药物管理局的要求,提交了超终将成为该年龄组三剂量疗法的前两剂量的数据。周五,他们说,他们预计在四月初可以得到三剂量的疫苗保护效果数据。
一些科学家对此持评判态度,建议监管机构在决定授权之前,应等待第三次注射的数据。
该公司表示,在6个月至2岁的幼儿中,疫苗产生的免疫反应与16至25岁的儿童相同。
信息来源 Reuters ,封面来源 healthday,版权属于原作者。




























